
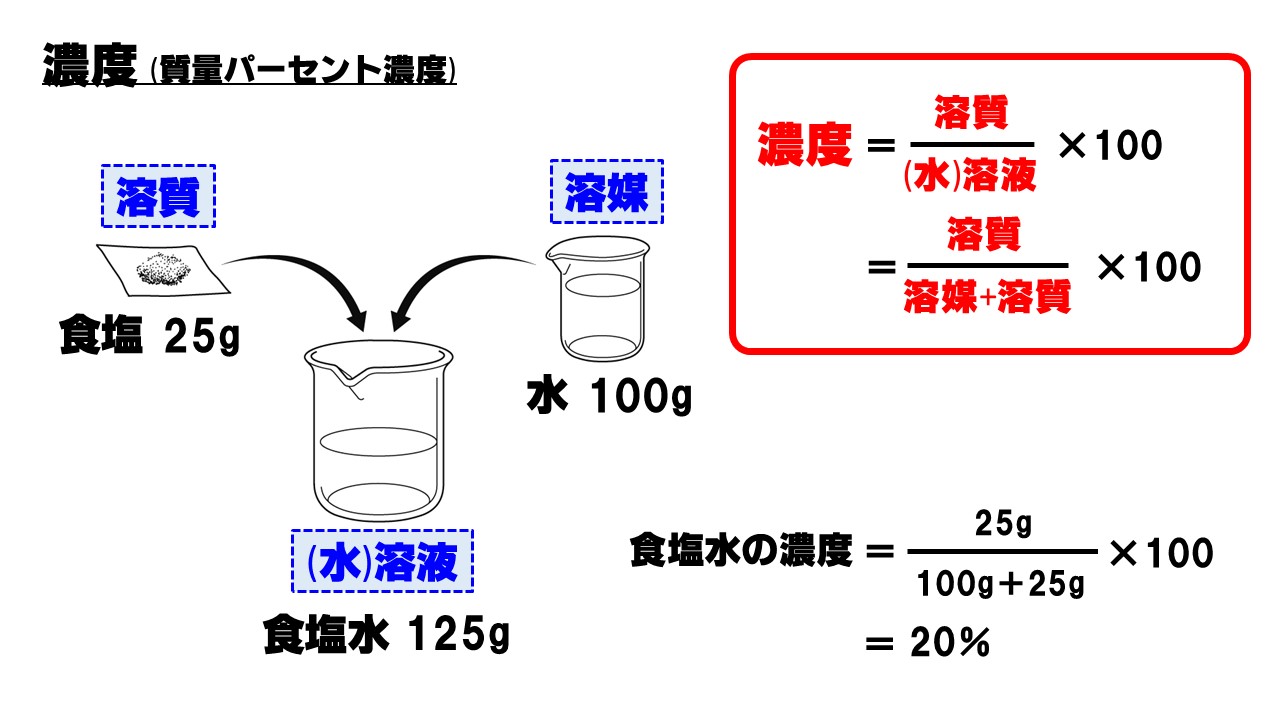
質量パーセント濃度の計算問題集 基本編 Menon Network
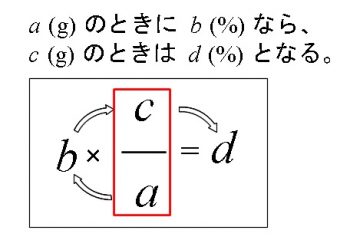
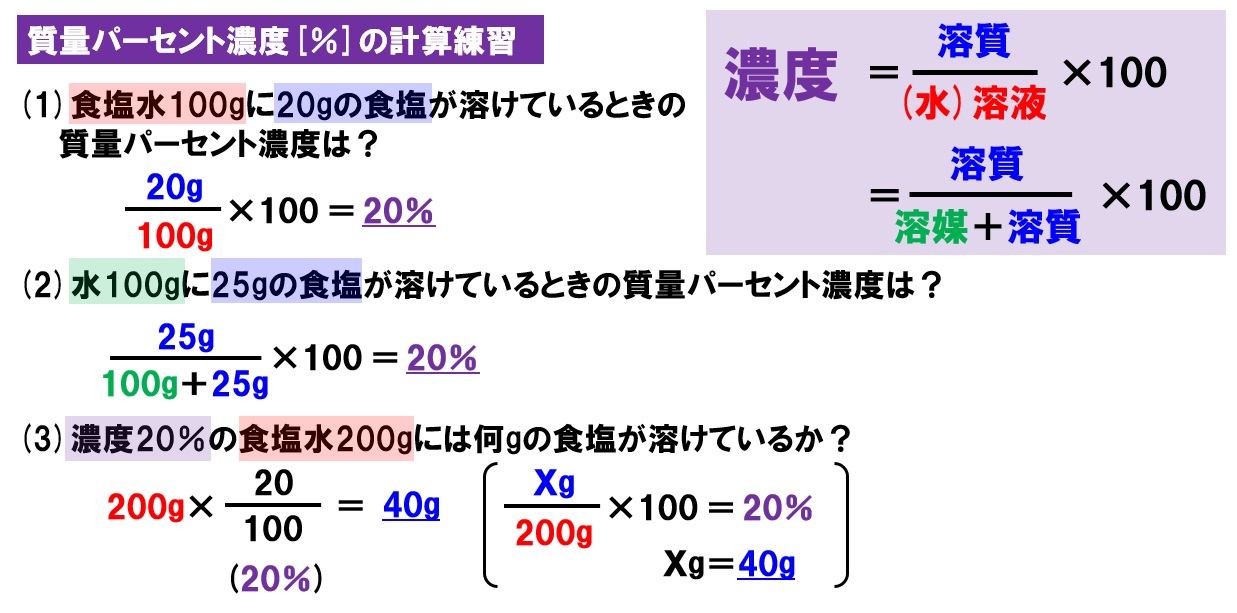
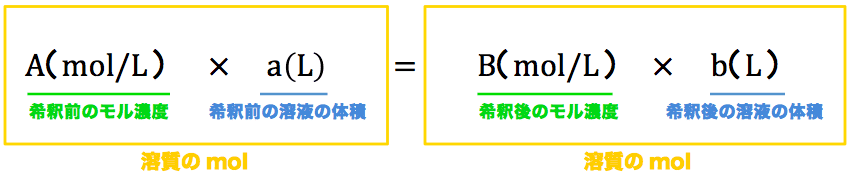
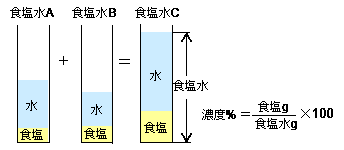
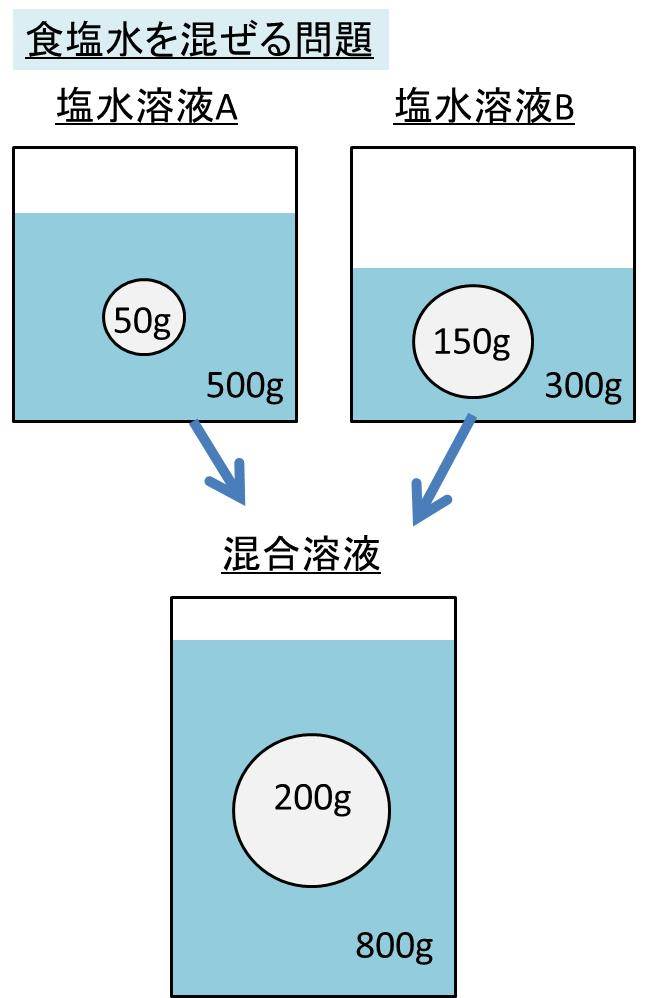
水をxとすると溶液は(x40)なので 溶質 = 溶液 × 濃度 100 より 式 40 = x40 × 8 100 答460g 次の問いに答えよ。ただし割り切れない場合は小数第2位を四捨五入せよ。 溶液400gの中に溶質56gが溶けている。この溶液の質量パーセント濃度はいくつか。 答14%《解説》 例 「12(%)の食塩水0(g)と,x(%)の食塩水300(g)を混ぜて,9(%)の食塩水になるとき,xを求めなさい.」 という問題のように,初めの条件が未知数のときは,方程式を作って解きます. 方程式の作り方は,最後にできる食塩水の濃度について式を立て,
水溶液 濃度 求め方
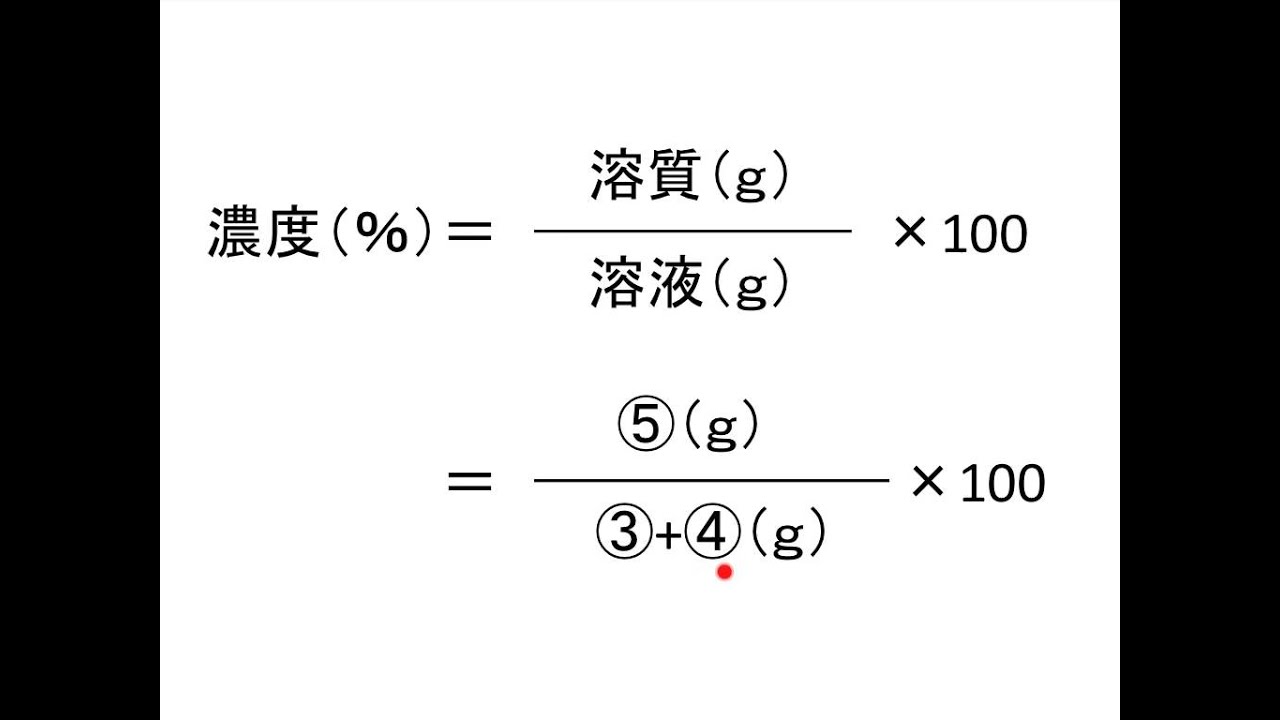
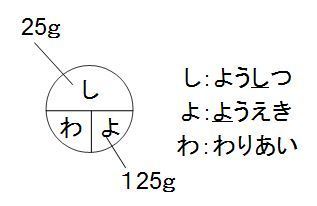
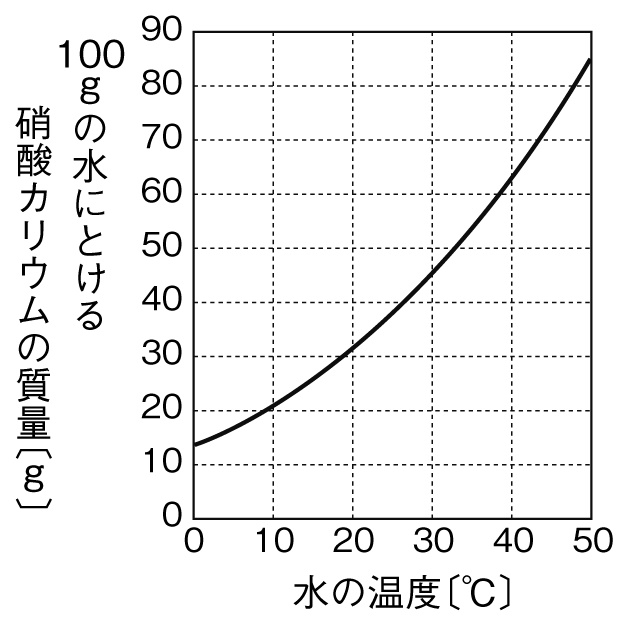
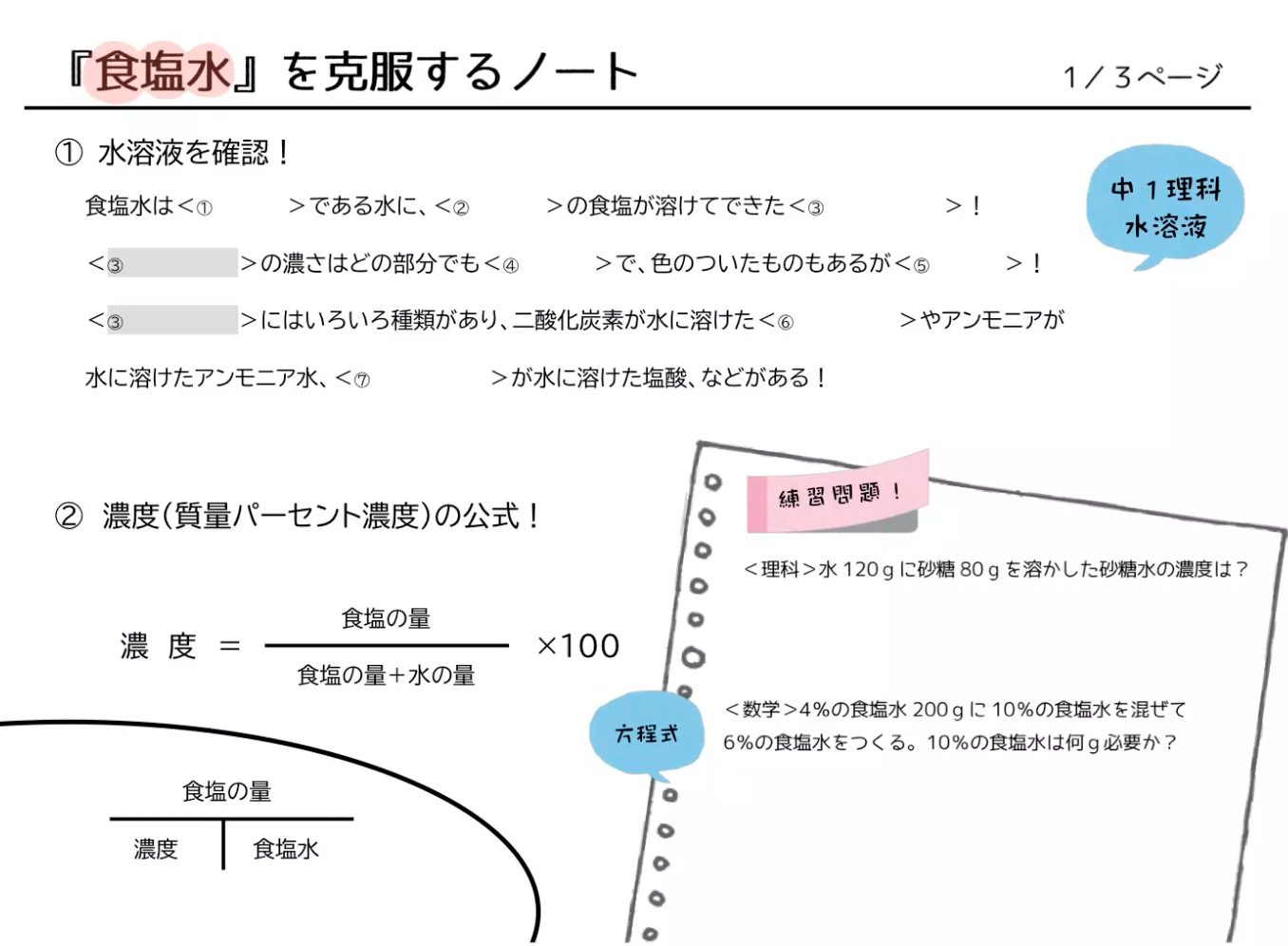
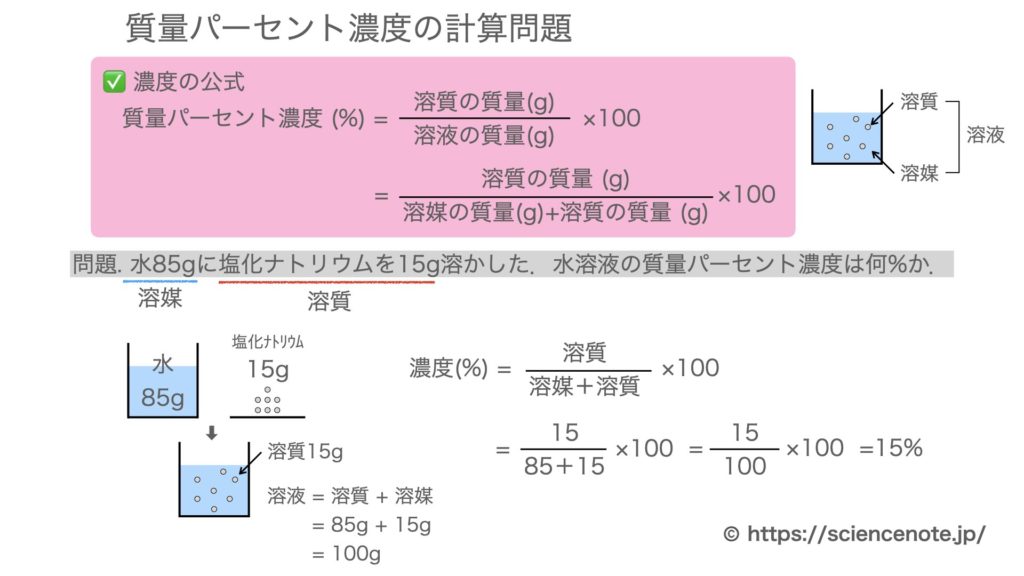
水溶液 濃度 求め方- 塩基性の溶液のときでも 求めなければならない物はたいがい pH。 pHを求めたい場合は、水素イオン濃度H じゃあ塩基性の場合、酸性溶液の 水素イオン濃度の求め方とは 違う方法を使うの? というと、実は違う。 それはこの水のイオン積があるおかげで、 質量パーセント濃度を求めなさい。 100 ÷ 250 × 100 = 40 答え 40% 難しい問題 水 160g に食塩 40g を溶かした。この水溶液の質量パーセント濃度は? 水溶液ではなく「水」となっていることに注意しよう。水溶液は水+質量なので水溶液は 160 40 = 0g です。
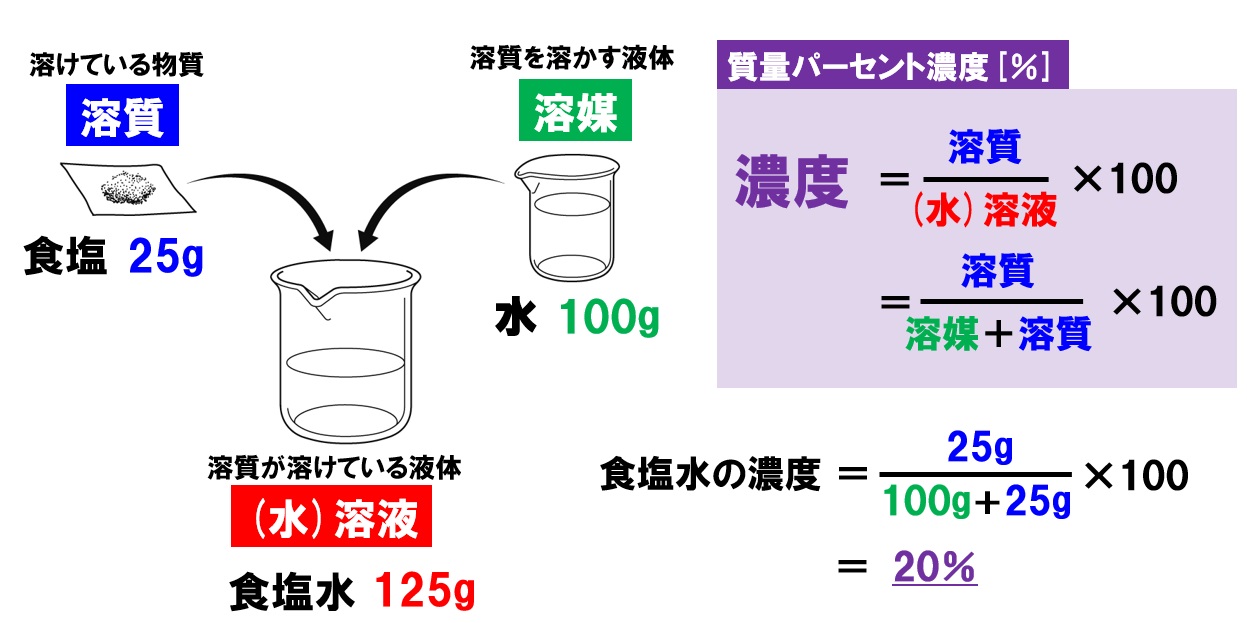
中1理科 水溶液と濃度 水溶液の性質と濃度計算 Pikuu
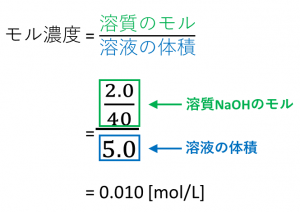
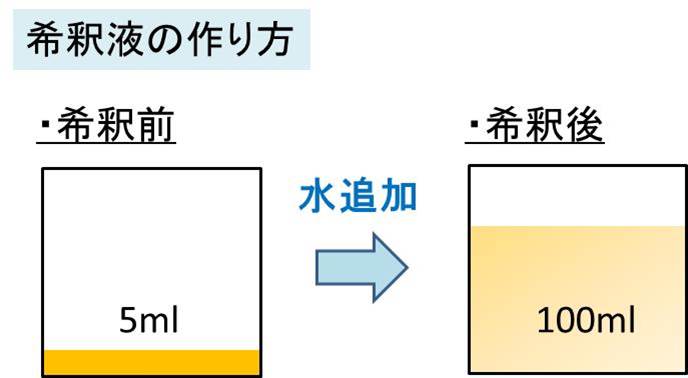
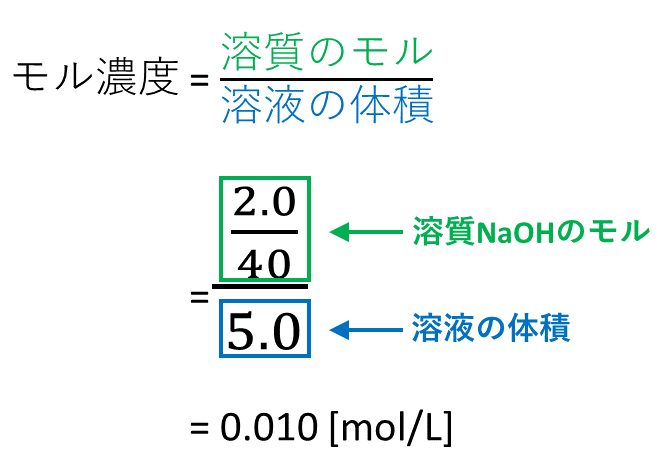
01 mol/L(100 mmol/L に相当)の水酸化ナトリウム溶液を使用します。 検査の濃度は、この標準液を蒸留水で適宜希釈して調製します。 安定性: 冷暗所(冷蔵庫)に保管すると、希釈した検査液は1 週間安定です。 必要な試薬:* 水酸化ナトリウム溶液たとえば、水酸化ナトリウムNaOH 40 gを水に溶かして、 Lにした水溶液のモル濃度は、 つぎのように求められます。水酸化ナトリウムのモル質量 濃度のはなし~中学生向け 質量パーセント濃度について~ 21年2月1日 学習内容解説ブログサービスリニューアル・受験情報サイト開設のお知らせ 学習内容解説ブログをご利用下さりありがとうございます。 開設以来、多くの皆様にご利用いただいて
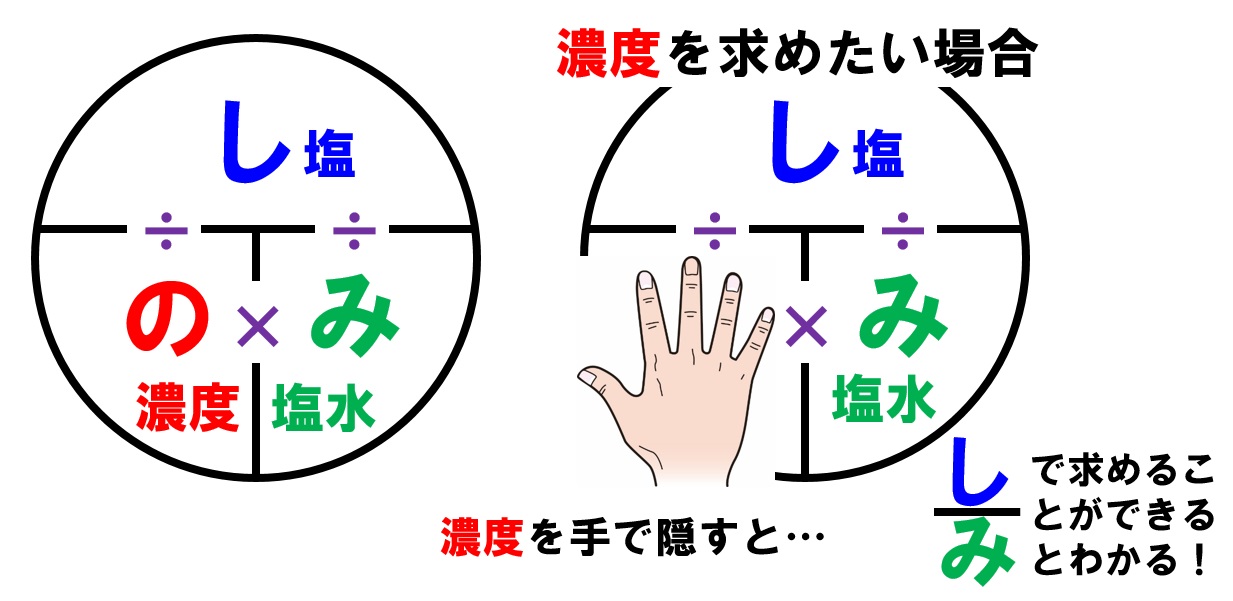
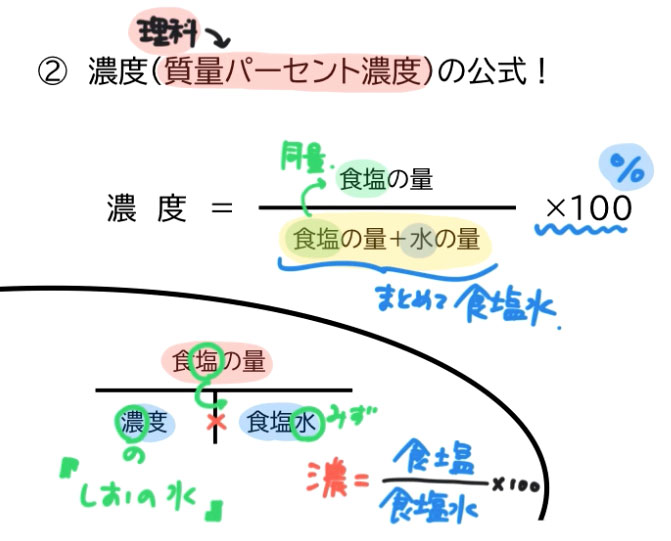
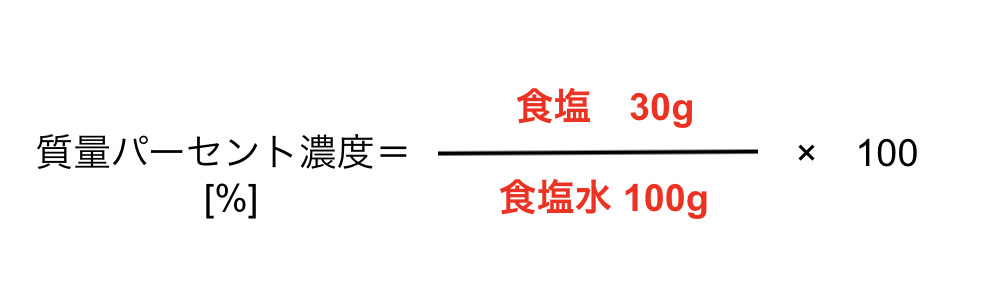
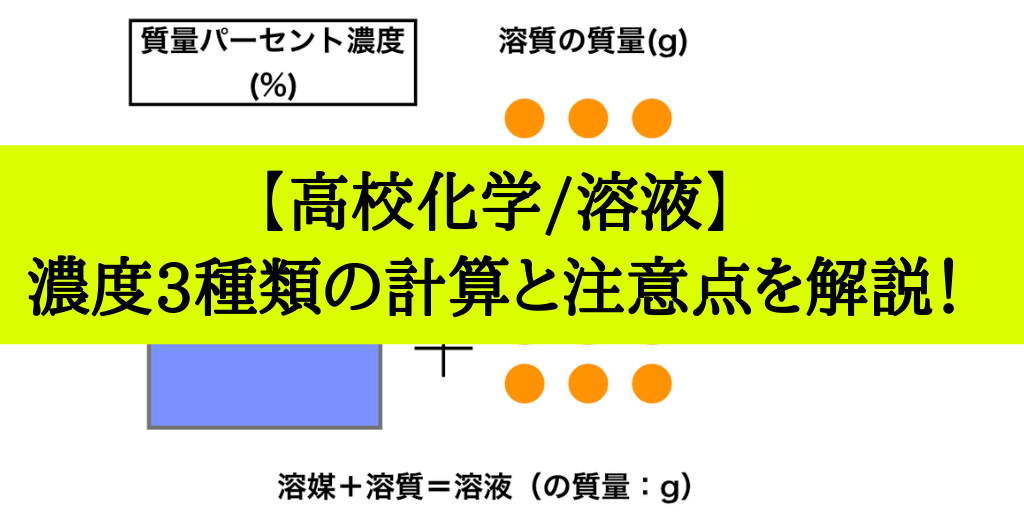
濃度の求め方(計算方法)を教えてください 下記は一般的な 濃度 (質量パーセント)の計算式です。 質量と体積が異なる場合・モル濃度の計算式は異なります。 質量パーセント濃度(%) = 溶質の量(g) ÷ 溶液 溶媒溶質 の量(g)×100 モル濃度をも求めなさい。 次の問題がわかりません>< わかる方回答お願いします。 (1)NaCl 2molは何gか。 ただし、硫酸の比重は117、分子量は98とする。 7 シュウ酸溶液60mlを濃度未知の水酸化ナトリウム溶液で中和したところ、150mlを要した。 問題の簡単な解き方にする天秤算と求め方の公式 投稿日:18年7月6日 更新日: 21年6月28日 食塩水の濃度の解き方に出てくる濃度とは、食塩 gを水 gに溶かした、食塩水全体の重さ(食塩水)に対しての食塩の重さの割合(%:パーセント)で表したものです。
水溶液 濃度 求め方のギャラリー
各画像をクリックすると、ダウンロードまたは拡大表示できます
 |  | |
 | 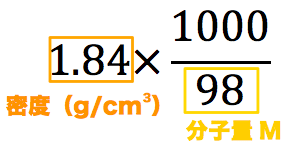 |  |
 | ||
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
 |  |  |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 |  | |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
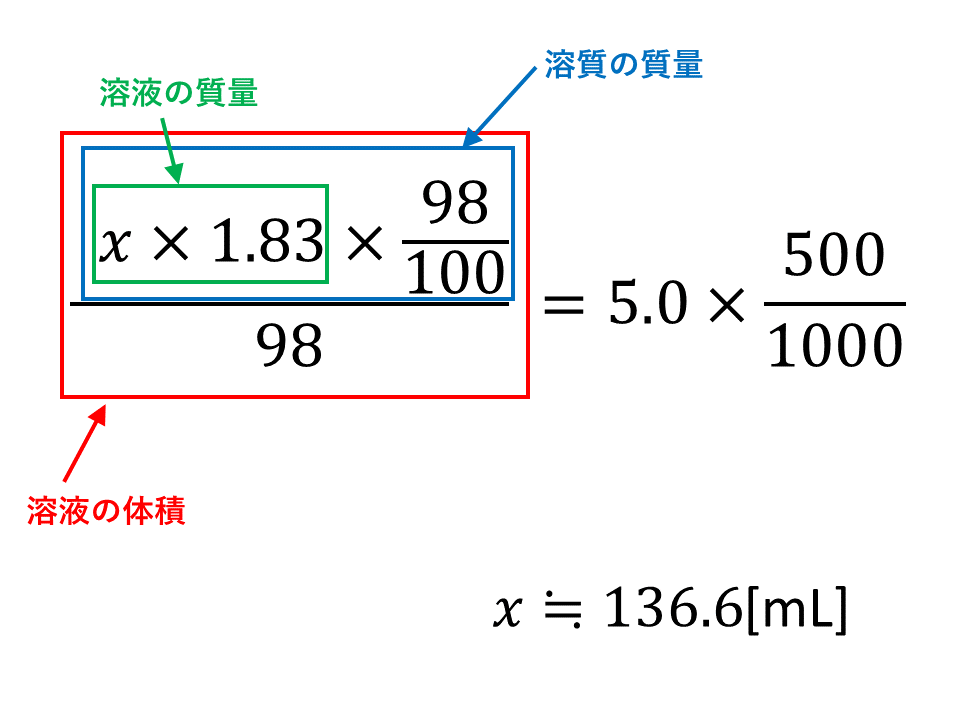 | 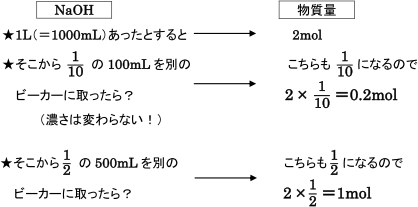 | |
 |  | |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
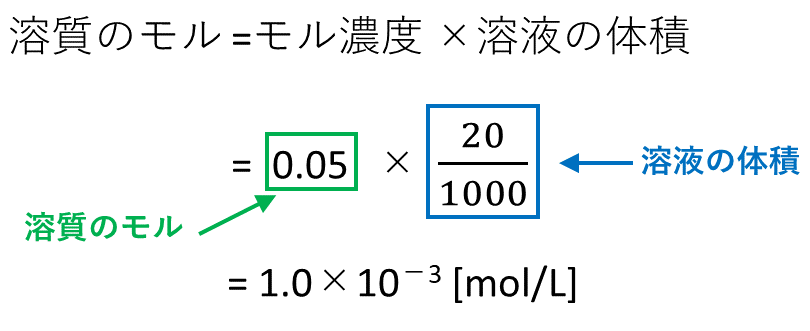 |  |  |
 |  |  |
 | 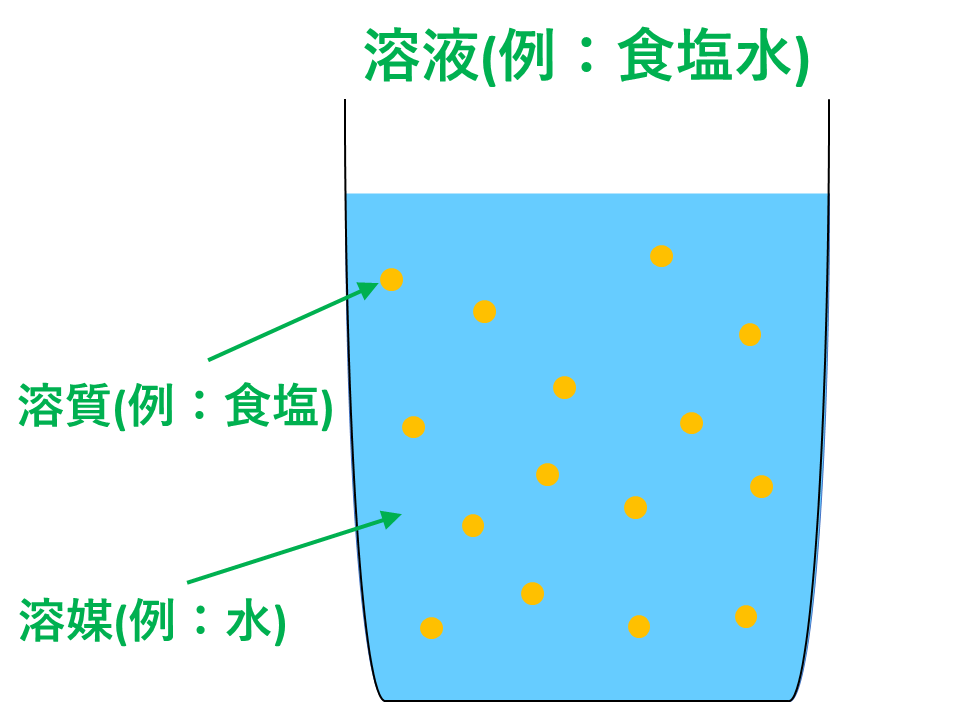 |  |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 | ||
 |  |  |
 |  | |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  | |
 | ||
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  | |
 |  |  |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 |  | 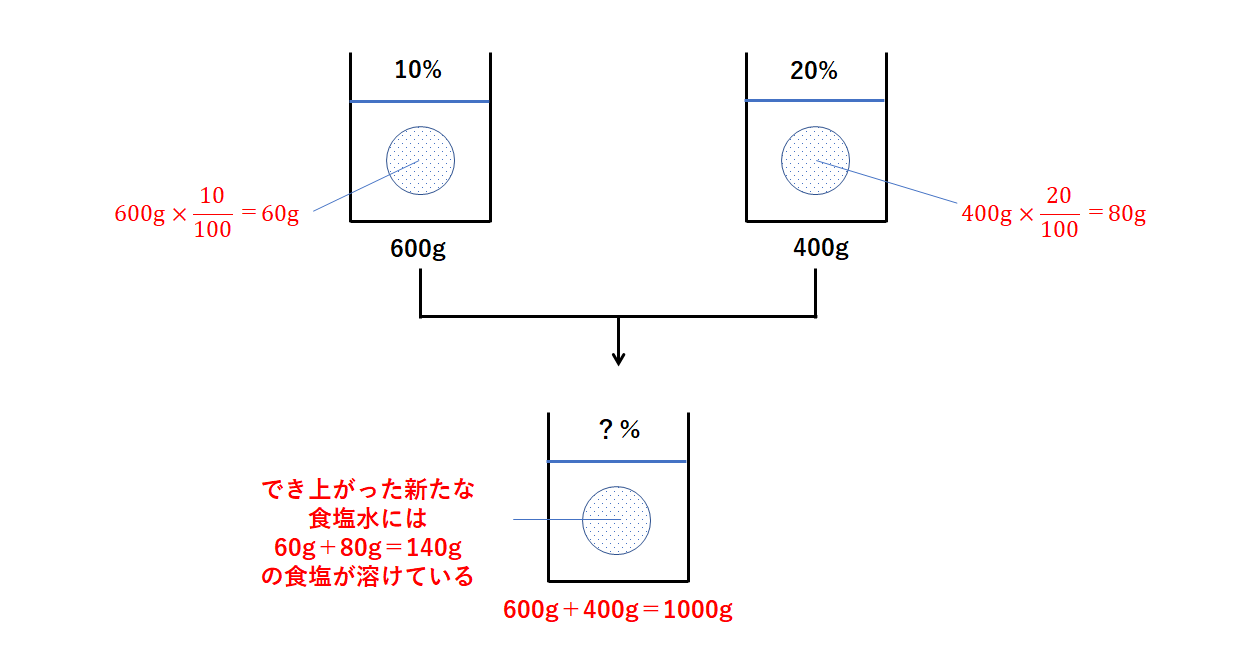 |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
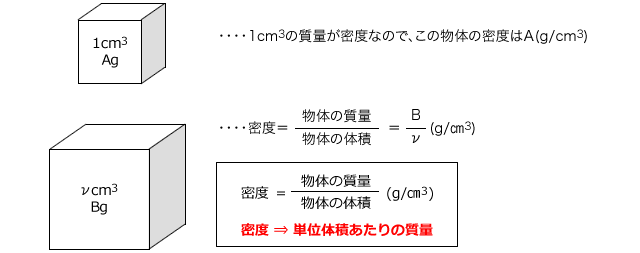 | 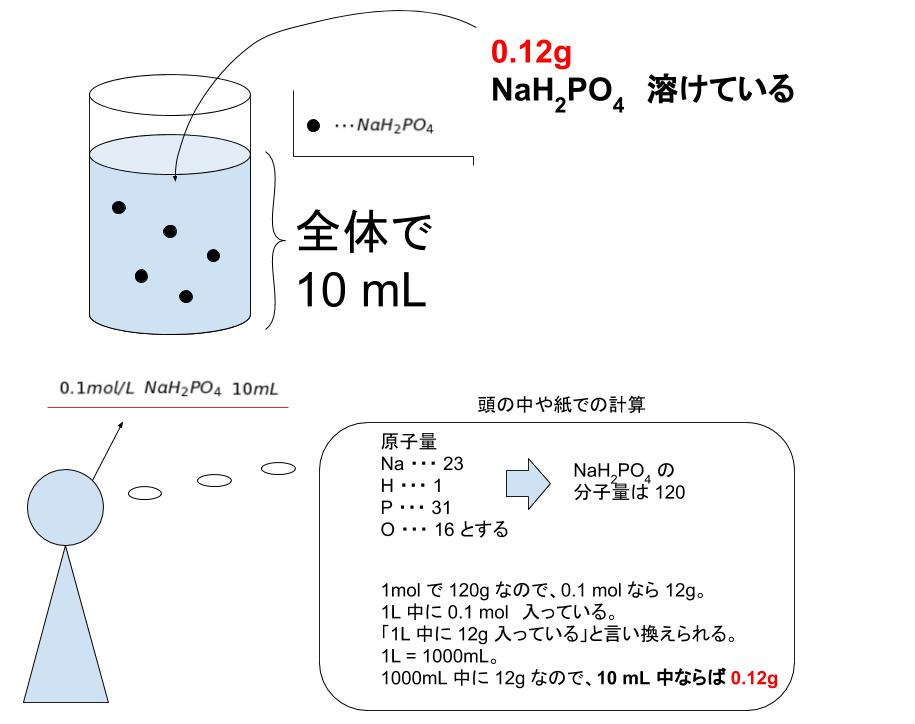 |  |
 |  | 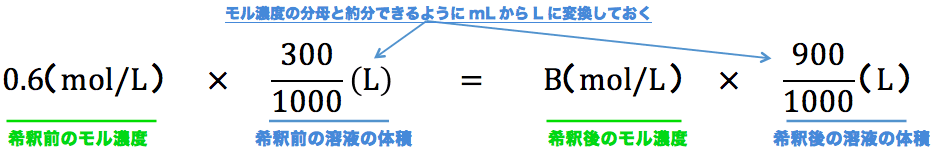 |
 |  |  |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
 |  |  |
「水溶液 濃度 求め方」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |
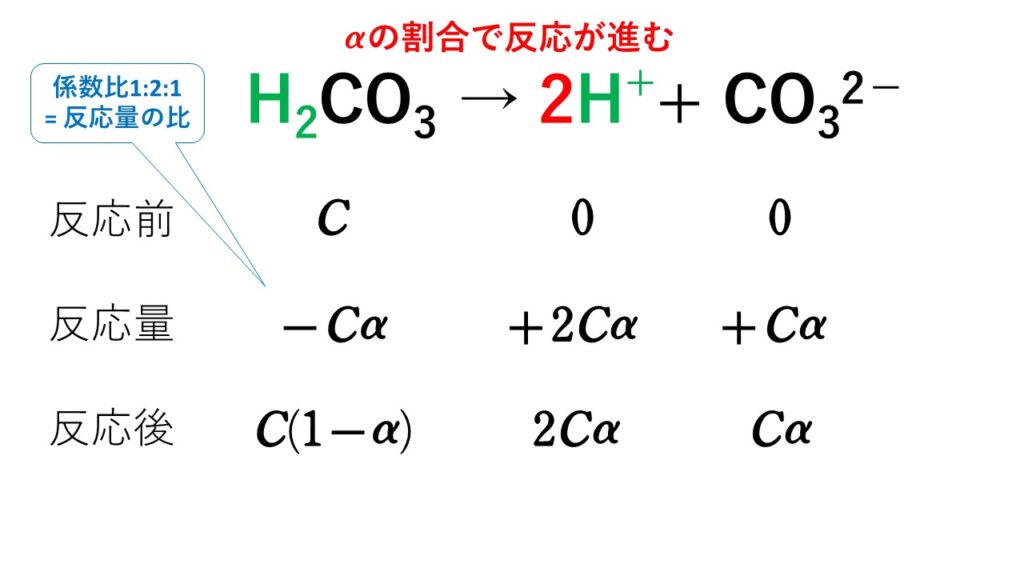
JIS K 0211 13 「分析化学用語(基礎部門)」 物質量濃度,モル濃度( molarity ) 溶液 1 L 中に含まれる溶質の物質量。要素粒子を明記する。 溶液の滴定分析,化学反応に関わる実験や反応機構など考える際には,溶液 1 L 中に含まれる溶質の物質量としての物質量濃度で表示するのが便利である。 酸塩基指示薬の使い方 中和滴定において、 標準溶液の滴下量に対するpH変化を表す図を、 滴定曲線と呼びます。 この曲線で中和点となるような標準溶液の量がわかれば、 濃度不明の溶液の濃度がわかるわけですね。 中和点は、一定のpHで鋭敏に色が変わる、
Incoming Term: 水溶液 濃度 求め方,




0 件のコメント:
コメントを投稿